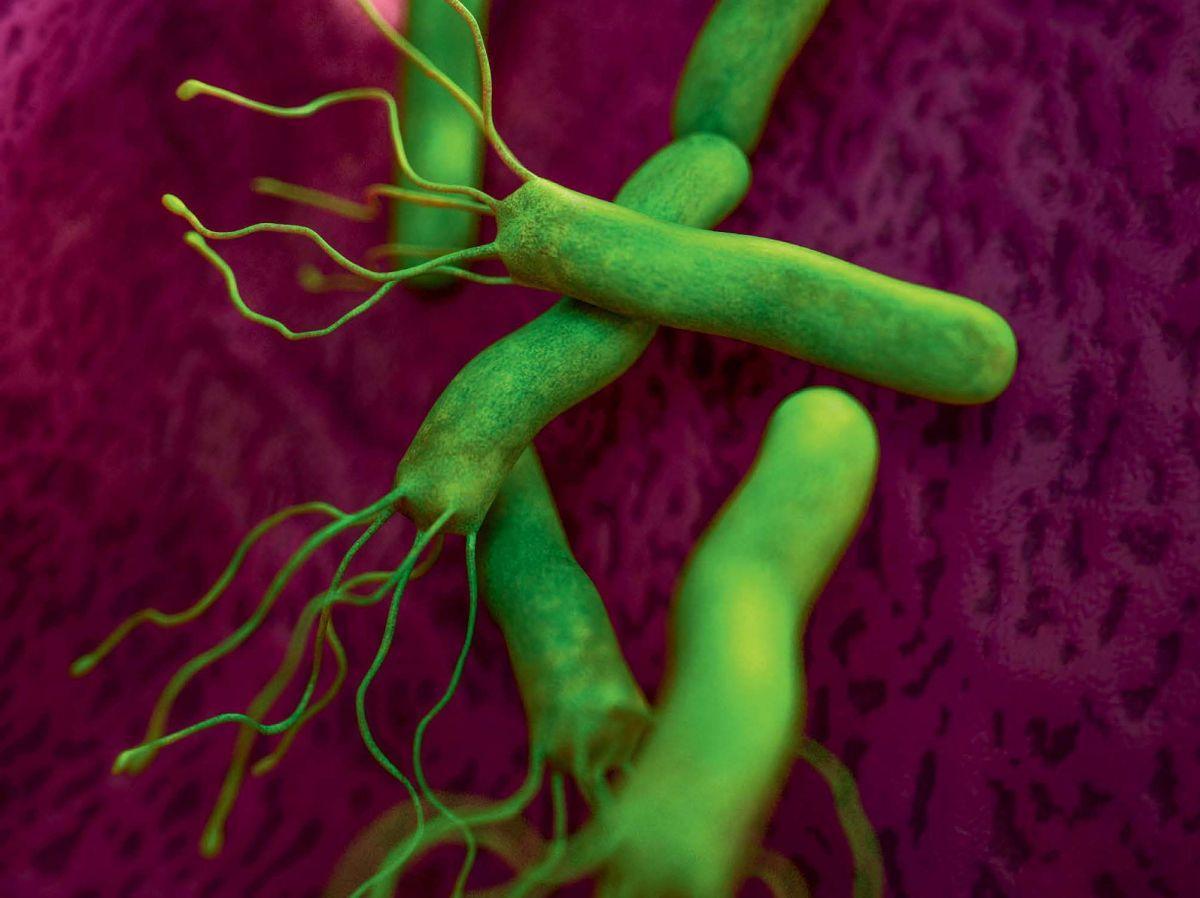
Africa-Press – Congo Brazzaville. Non, les ulcères de l’estomac ne sont pas tous liés au stress ou douloureux. Sept sur dix sont dus à Helicobacter pylori, une petite bactérie discrète, spiralée et mobile, les trois autres étant en lien avec une prise d’anti-inflammatoires non stéroïdiens ou d’aspirine. Exclusivement humaine, cette bactérie est présente dans l’estomac d’une personne sur deux dans le monde, une sur cinq en France, et sa responsabilité dans l’inflammation chronique de l’estomac ne fait plus débat.
Voilà tout juste vingt ans que la mise en évidence du rôle majeur joué par H. pylori dans la genèse des ulcères a été récompensée par un prix Nobel. Cette découverte n’aurait jamais vu le jour si Barry Marshall, l’un des deux scientifiques récompensés, n’avait décidé de tester les effets de la bactérie sur son propre estomac. Pourquoi un tel geste? Parce que dans les années 1980, « personne, ni les gastro-entérologues, ni l’industrie pharmaceutique, ne voulait y croire », résume le Pr Francis Mégraud, bactériologiste au CHU de Bordeaux. Il aura fallu près d’un demi-siècle pour que la communauté scientifique finisse par admettre qu’un germe puisse survivre dans un environnement aussi acide que l’estomac.
Aujourd’hui, « on sait que la bactérie est responsable dans 80 % des cas d’une gastrite chronique qui reste souvent asymptomatique. Mais celle-ci peut évoluer en ulcère dans 15 à 20 % des cas, ou plus rarement – 1 % – en cancer », détaille le Dr Émilie Bessède, maîtresse de conférences et praticienne hospitalière (université et CHU de Bordeaux). Helicobacter pylori est d’ailleurs la première bactérie à avoir été reconnue directement cancérigène en 1994, onze ans avant le Nobel.
En 2025, on sait désormais la diagnostiquer par des moyens plus ou moins invasifs, apprécier la sévérité des lésions qu’elle induit dans l’estomac par l’analyse dite anatomopathologique – examen à l’œil nu et au microscope – des biopsies réalisées pendant une fibroscopie, et aussi la traiter par au moins deux antibiotiques et un anti-acide – les fameux inhibiteurs de la pompe à protons (IPP) -, dont le traitement au long cours est rarement justifié. Une révolution en tout cas pour tous les ulcéreux à qui on a suggéré pendant des dizaines d’années de réduire leur stress, de se mettre au yoga ou encore d’aller vivre à la campagne…
On sait également que l’interaction avec la bactérie coupable et nos estomacs commence « le plus souvent dans l’enfance avant l’âge de 10 ans, par le biais d’une transmission dite interfamiliale orale, précise Émilie Bessède, c’est-à-dire par contact direct avec les liquides de l’estomac (régurgitations, vomissements). Des études ont démontré que le risque pour un enfant d’être contaminé est très élevé si ses deux parents sont positifs, moins si un seul parent est touché et encore moins si aucun des deux n’est infecté. » Une fois installée dans la paroi de l’estomac qui l’hébergera la vie entière si on ne tente pas de l’en déloger, elle peut induire localement une inflammation de la muqueuse, plus ou moins agressive, évoluant très progressivement au fil du temps.
Les préoccupations des médecins se focalisent aujourd’hui sur les solutions pour freiner l’antibiorésistance – elle a doublé en vingt ans -, optimiser les traitements disponibles tout en ne s’interdisant pas de rêver à un très hypothétique vaccin – pour lequel un seul essai clinique de phase 3 a été mené, mais c’était il y a plus de dix ans. Pour parvenir à faire disparaître la bactérie avec 90 % de succès, il faut utiliser plusieurs molécules.
En France, on a souvent recours, sans étude préalable de la sensibilité de la souche aux antibiotiques, à une association fixe, soit… 12 gélules par jour (en quatre prises pendant 14 jours). « Mais cette approche probabiliste reste empirique et est de plus en plus difficile à tenir face à la progression de l’antibiorésistance « , indique le Dr Frédéric Heluwaert, gastro-entérologue à l’hôpital d’Annecy.
Attention aux médicaments contre l’acidité
IPP: trois lettres qui désignent les inhibiteurs de la pompe à protons, ces molécules efficaces et bien tolérées utilisées pour réduire la sécrétion acide de l’estomac. Indiqués dans la prise en charge du reflux gastro-œsophagien et des ulcères gastro-duodénaux, ils sont massivement prescrits: plus de 16 millions de Français (25 % de la population !) en ont déjà pris. En 2020 et en 2022, la Haute Autorité de santé (HAS) a sonné l’alarme, estimant que plus de la moitié de ces usages n’étaient pas justifiés.
Ils sont en effet souvent prescrits systématiquement ou sur des durées trop longues, et renouvelés pendant des années sans réévaluation de leur balance bénéfice-risque. Pourtant, selon des études récentes, leur prise chronique est associée à des effets délétères comme le risque de démence ou une moindre efficacité des chimiothérapies.
Des tests bactériologiques ultrasensibles sont disponibles
Car non seulement la bactérie résiste, mais les médecins et les patients ne sont pas toujours de bons élèves, les premiers ne vérifiant pas systématiquement en fin de traitement si celui-ci a été efficace, les seconds ne prenant pas forcément leur traitement jusqu’au bout en raison des nombreux effets secondaires.
Publiée au printemps dernier dans la revue Helicobacter, une étude espagnole conduite auprès d’une centaine de gastro-entérologues a montré que seuls un tiers des praticiens respectaient les recommandations de suivi des traitements. Ils ne vérifiaient par exemple pas toujours leur efficacité par un test respiratoire à l’urée plusieurs semaines après l’arrêt du traitement.
Détecter l’infection par le souffle
Ce test respiratoire repose sur la capacité de la bactérie à sécréter une enzyme, l’uréase, qui détruit l’urée. Le patient boit une solution contenant de l’urée marquée au carbone 13 qui sera détruite par l’enzyme si la bactérie est présente. Le test par analyse du souffle est alors dit positif. Son intérêt est double. Il détecte la présence de la bactérie et peut aussi évaluer l’efficacité d’un traitement s’il est réalisé un mois après son arrêt. Devenu alors négatif, il prouve que la bactérie a disparu.
Heureusement, les pratiques sont en train de changer. Depuis environ deux ans, des tests bactériologiques d’amplification génique par PCR (polymerase chain reaction) ultrasensibles sont disponibles. Capables non seulement de détecter la présence de la bactérie, mais aussi d’identifier les mutations de résistance présentes au niveau de l’ADN bactérien, ils sont désormais remboursés et peuvent être réalisés directement par les gastro-entérologues au moment de la fibroscopie, pour l’analyse bactériologique de leurs biopsies. « Ce qui permet de prédire si la souche sera sensible ou résistante à la clarithromycine [principal antibiotique administré] et nous donne enfin la possibilité de sortir de la démarche probabiliste pour une approche intelligente et personnalisée, permettant de choisir avec certitude un antibiotique qui sera efficace « , précise Frédéric Heluwaert. Une démarche encouragée par le groupe d’Étude français des Helicobacter auprès des gastro-entérologues qui commencent progressivement à les utiliser.
Mais d’autres nouveautés sont attendues. De récents travaux insistent sur l’importance du contrôle de la sécrétion de l’acidité dans l’estomac pour l’efficacité du traitement, au-delà des antibiotiques. Aussi, de nouveaux anti-acides, plus efficaces que ceux actuellement disponibles, ont été développés au Japon où ils sont déjà commercialisés. Selon des résultats qui restent à confirmer sur d’autres populations, ils sont tellement puissants qu’ils permettraient même de se passer de la clarithromycine !
Face à ces progrès, pourrait-on dès lors envisager de rechercher systématiquement Helicobacter pylori pour s’en débarrasser? « Non, pas en population générale, insiste Frédéric Heluwaert. Mais oui, chaque fois qu’est réalisée une endoscopie. Proposer un traitement ne sera possiblement bénéfique que chez 20 % des patients traités. En effet, dans 80 % des cas, il sera probablement inutile car la cohabitation se serait déroulée toute la vie sans aucune complication. Mais nous n’avons pas à ce jour de moyen fiable pour prédire qui fera les complications ou non. »
En pratique, les décisions se prennent au cas par cas, selon l’âge de la personne au moment de la découverte de l’infection, de l’éventuelle présence de symptômes, d’antécédents familiaux de cancers de l’estomac… Or dès 2019, la Haute Autorité de santé alertait déjà à propos d' »écarts mis en évidence entre les enquêtes de pratique et les recommandations officielles « : traitements antibiotiques souvent prescrits à l’aveugle et pas toujours aux doses efficaces nécessaires, trop peu de contrôle de leur efficacité par le test respiratoire, etc. « Chaque année, environ 150.000 nouveaux patients sont diagnostiqués positifs à Helicobacter en France et mis sous antibiothérapie, et nous voulons savoir qui fait quoi, comprendre comment se coordonne la prise en charge entre médecins généralistes et gastro-entérologues « , indique Frédéric Heluwaert.
Une étude en France pour améliorer la prise en charge
C’est dans ce but qu’il coordonne l’étude Helite, première base de données hexagonale qui va rassembler différentes informations: les circonstances de diagnostic, les types de traitements prescrits avec ou sans étude de la sensibilité aux antibiotiques, sans oublier le suivi de leur efficacité et l’observance des patients… Déjà 1500 dossiers, tous issus de la région Savoie, point de départ de l’étude, ont été inclus mais le travail doit s’étendre à l’ensemble du territoire. Il permettra à terme de présenter des recommandations pour améliorer la prise en charge.
Il demeurera cependant impossible de proposer des règles universelles valables partout sur la planète. « Il existe d’importantes disparités géographiques de prévalence de l’infection (70 % en Asie et en Afrique, 40 % en Europe de l’Est, 15 % en France), précise Frédéric Heluwaert. Par ailleurs, le taux de résistance à l’un des antibiotiques, la clarithromycine, varie de 30 % en Italie à 20 % en France, ou 5 % au Danemark. »
De plus, les souches bactériennes ne sont pas toutes identiques, ni responsables partout des mêmes pathologies, certaines étant plus agressives que d’autres. Et si la bactérie est présente dans un estomac sur deux à l’échelle mondiale, le risque qu’elle provoque un cancer reste heureusement faible (1 %). En France, c’est environ 6000 nouveaux cas par an. Mais là encore, plusieurs facteurs entrent en jeu: le type de souche, mais aussi le profil du patient, c’est-à-dire « ses facteurs génétiques, environnementaux (exposition au tabac) et alimentaires (alimentation trop salée, riche en viande rouge), tous se combinant entre eux dans l’apparition et la progression de la maladie », détaille Émilie Bessède. Pourtant, avec un traitement antibiotique bien prescrit et bien suivi, on peut éviter l’apparition de ce cancer en faisant disparaître la bactérie.
Coupler le dépistage du cancer de l’estomac à celui du côlon
Par chance, il n’y a jamais d’urgence à traiter car les dégâts au niveau des cellules de l’estomac ne surviennent qu’après plusieurs décennies, « selon une spirale qui passe par différents stades qu’il est possible d’enrayer à condition d’agir au bon moment, avant un point dit de non-retour, celui de l’apparition de lésions précancéreuses, soit en moyenne vers 50 ans, détaille Frédéric Heluwaert. Au-delà de cette limite, traiter la bactérie reste nécessaire, mais la spirale étant lancée et ne pouvant plus être interrompue, une surveillance par endoscopie pourra être nécessaire. » Reste bien sûr le dépistage.
Comme l’a démontré une solide étude épidémiologique parue l’été dernier dans la revue Nature, menée par le Centre international de recherche sur le cancer (Circ) de Lyon, si aucune mesure n’est mise en place pour les années à venir, d’ici à 2050 plus de 10 millions de cas de cancers de l’estomac surviendront dans le monde chez des personnes nées entre 2008 et 2017 – dont la très grande majorité se produira en Afrique -, avec 44.000 cas rien que pour la France. Aussi, les auteurs plaident d’ores et déjà en faveur de la mise en place de stratégies dites « screen and treat »: un dépistage précoce pour rechercher la bactérie, une fibroscopie gastrique et un traitement avant que la spirale ne s’emballe.
Si ces programmes étaient généralisés, 75 % des cas de cancers pourraient être évités. Or, à ce jour, seuls certains États d’Asie (Japon, Corée du Sud, Taïwan), c’est-à-dire des lieux cumulant prévalence élevée de l’infection, souches virulentes mais aussi solidité des systèmes de santé, ont su opter avec succès pour ces programmes de dépistage.
En Europe aussi, les choses commencent à bouger. Les meilleures façons de dépister et de traiter étaient à l’ordre du jour du 38e colloque du Groupe d’étude européen sur Helicobacter et le microbiote (EHMSG) qui s’est tenu à Rome en septembre. Le groupe de réflexion Togas (Towards gastric cancer screening implementation in the European Union) y a présenté les résultats d’expériences pilotes en Lettonie, Slovénie, Pologne et Allemagne pour inciter la population et les personnels de santé à se faire dépister.
Une autre piste serait aussi de coupler le dépistage du cancer du côlon à celui de l’estomac, mais reste à trouver le moment idéal, vers 50 ans ou même encore plus tôt, vers 45 ans. Se débarrasser à 100 % d’ H. pylori ne sera pas facile: comme l’ont montré des chercheurs de l’institut Max-Planck (Allemagne), elle est présente depuis au moins 100.000 ans dans l’estomac des humains.
Une bactérie discrète mais tenace
Petite (entre 2 et 3 micromètres), très solidement ancrée dans l’estomac grâce à la synthèse de molécules dédiées (adhésines), particulièrement mobile avec ses fins filaments… Autant d’atouts qui permettent à H. pylori de s’adapter et de proliférer dans un milieu pour le moins hostile car très acide. Elle est même capable de s’enrouler et de changer de forme pour mieux résister ! C’est d’abord avec la sécrétion d’une enzyme, l’uréase, qui neutralise son environnement immédiat que la bactérie survit au niveau du mucus, le film auto-protecteur produit en permanence par l’estomac pour protéger ses propres cellules de l’acide chlorhydrique et des enzymes de la digestion. Au fil du temps, l’inflammation chronique locale s’exprime de manière plus ou moins agressive selon les types de souches en jeu, la diversité génétique de la bactérie étant très riche.
Tout peut donc se stabiliser au stade inflammatoire d’une gastrite mais aussi évoluer, au bout de plusieurs années, vers un ulcère ou un cancer. « Différents facteurs de virulence sont aujourd’hui connus, les principaux étant les protéines VacA et CagA, mais toutes les souches ne possèdent pas l’îlot de pathogénicité CagA impliqué dans les processus de cancérisation », détaille le Dr Émilie Bessède, du CHU de Bordeaux. Et la spécialiste de poursuivre: « On a découvert récemment que la bactérie n’est pas la seule responsable et que le microbiote participe lui aussi activement à la cancérisation, mais selon des mécanismes inconnus qui restent à élucider. »