Africa-Press – Djibouti. Elle s’appelle PINK1 et bien qu’elle soit connue depuis 20 ans, c’est la première fois que des scientifiques parviennent à la voir clairement dans des travaux publiés dans Science. Cette protéine, essentielle à la destruction des mitochondries lorsqu’elles ne fonctionnent plus, est mutée chez de nombreux patients atteints d’une forme précoce de la maladie de Parkinson. Ces nouveaux travaux, conclusion de plusieurs années d’efforts, pourraient permettre d’explorer de nouvelles voies de traitement pour ces patients.
Des maladies de Parkinson précoces dues à des protéines mutées
5 à 10% des cas de la maladie de Parkinson, qui touche presque 200.000 personnes rien qu’en France, sont dues à une mutation génétique circulant dans les membres d’une même famille. De ces mutations, les deux plus fréquentes concernent les protéines Parkin et PINK1, et sont responsables d’un début précoce de la maladie entre 21 et 45 ans environ. Les patients dont la maladie est caractérisée par des mutations à PINK1 ont un âge médian d’apparition des premiers symptômes de 32 ans, avec des tremblements, une bradykinésie (mouvements lents) et de la rigidité très semblables aux autres malades de Parkinson, d’après la base de données GeneReviews.
Si PINK1 est si importante que son altération peut causer la maladie, c’est qu’elle permet d’enclencher la destruction des mitochondries (centrales énergétiques des cellules) endommagées. Ce processus appelé mitophagie évite que ces mitochondries dysfonctionnelles ne s’accumulent dans la cellule, ce qui mènerait à la mort de cette dernière. C’est justement ce qu’il se passe chez les malades possédant une version mutée de PINK1.
La première image de PINK1 arrimée à une mitochondrie
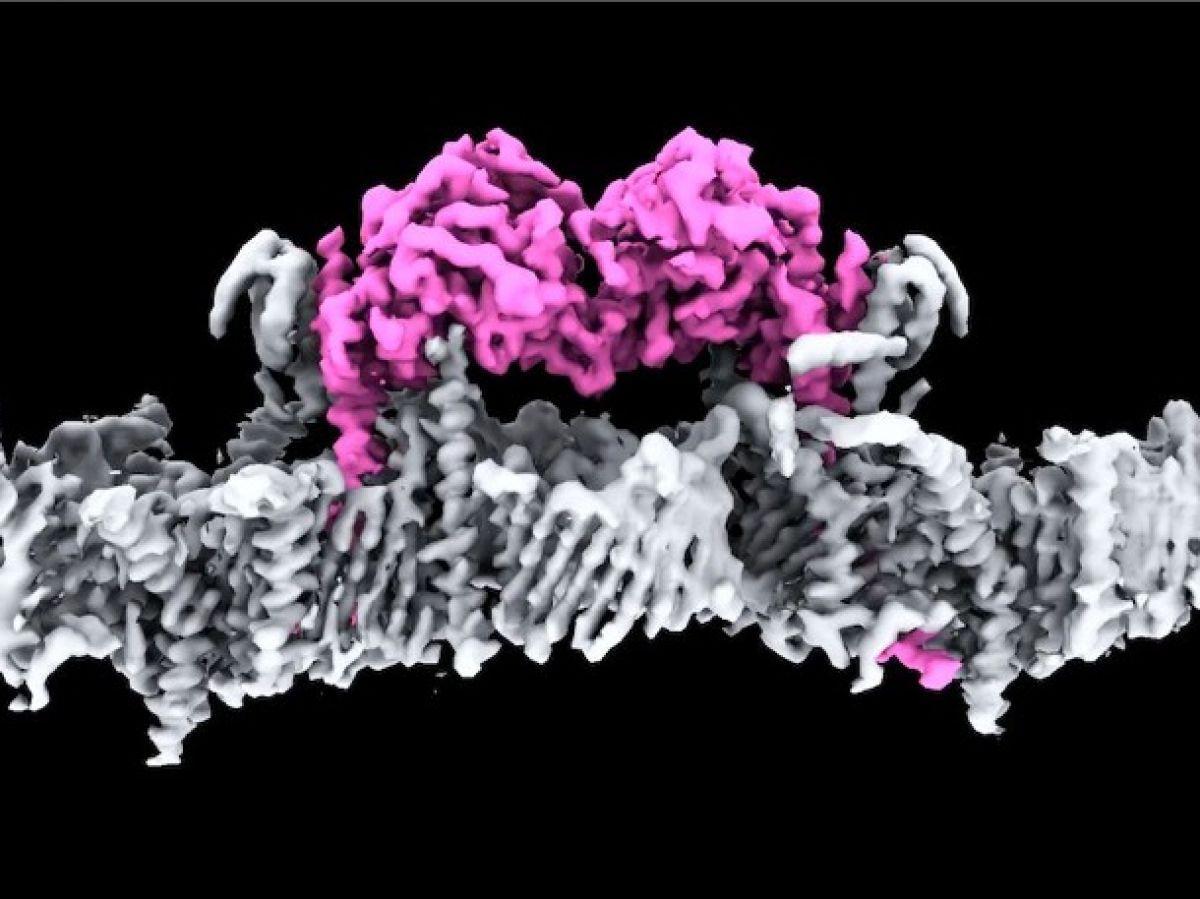
« C’est la première fois que nous pouvons voir comment PINK1 s’arrime à la surface de la mitochondrie endommagée », explique la chercheuse Sylvie Callegari, première autrice de ces travaux. « Dans les mitochondries saines, PINK1 est difficile à observer parce qu’il se trouve à l’intérieur des mitochondries et est ensuite dégradée », décrit Sylvie Callegari. Lorsque les mitochondries sont défaillantes, PINK1 s’accumule à la surface jusqu’à s’associer à une autre molécule PINK1 (pour former un dimère) et s’activer l’une l’autre. Une fois actives, les deux molécules PINK1 se séparent et chacune peut s’attacher à une petite protéine appelée ubiquitine et la marquer. « Ce signal d’ubiquitine marqué déclenche alors le processus de nettoyage des mitochondrie, la mitophagie », résume la chercheuse. Chez les malades de Parkinson, les mutations de PINK1 peuvent être localisées à plusieurs endroits de la protéine et entraver son fonctionnement en déstabilisant ses liens avec les autres protéines.
Le parcours de PINK1 est méticuleusement retracé grâce à des observations en cryo-microscopie électronique, qui permet d’obtenir des images en 3D des tissus biologiques. D’une précision de 3,1 Angstrom (soit 0,31 millionième de millimètre), elle révèle notamment la structure du dimère de PINK1 arrimée à la surface de la mitochondrie (voir l’illustration ci-dessus). « L’un des principaux obstacles à la visualisation de PINK1 est qu’il y en a peu dans la cellule et que nous avons donc eu besoin de très grandes quantités de cellules (près de 10 litres) pour obtenir suffisamment de PINK1 que nous pourrions ensuite utiliser pour la visualisation par cryo-microscopie électronique. » En outre, il est difficile d’obtenir une image en bonne résolution d’un sujet en mouvement, aussi les chercheurs ont-ils dû rendre PINK1 la plus stable possible.
Stabiliser PINK1 sur les mitochondries pour traiter la maladie de Parkinson
Si introduire une molécule PINK1 fonctionnelle dans le cerveau des malades est une option actuellement difficilement envisageable, les chercheurs pensent plus réaliste de chercher à la rendre plus active, notamment en la rendant plus stable dans les mitochondries. « Des sociétés pharmaceutiques développent actuellement de petites molécules censées stabiliser PINK1 pour la rendre plus active. Nous pouvons maintenant tester cela en utilisant notre structure pour voir exactement où ces molécules se lient dans notre structure », anticipe Sylvie Callegari. « L’utilisation d’une protéine artificielle, telle qu’une protéine générée à l’aide de l’IA, est une autre option intéressante sur laquelle nous travaillons actuellement. »
Pour plus d’informations et d’analyses sur la Djibouti, suivez Africa-Press