Africa-Press – Mali. Make the impossible possible”: tel est le slogan du centre de recherche biomédicale Edmond J. Safra (Clinatec). Comme un espoir face à une maladie neurodégénérative qui touche plus de 8 millions de personnes autour du globe, le centre de recherche intégré au CEA de Grenoble développe l’utilisation de la photobiomodulation intracrânienne (lire l’encadré ci-dessous) pour ralentir l’évolution de la maladie de Parkinson: un projet porté par Cécile Moro, directrice de recherche au CEA, sobrement appelé NIR (Near InfraRed ou proche infrarouge en français).
Qu’est-ce que la photobiomodulation intracrânienne ?
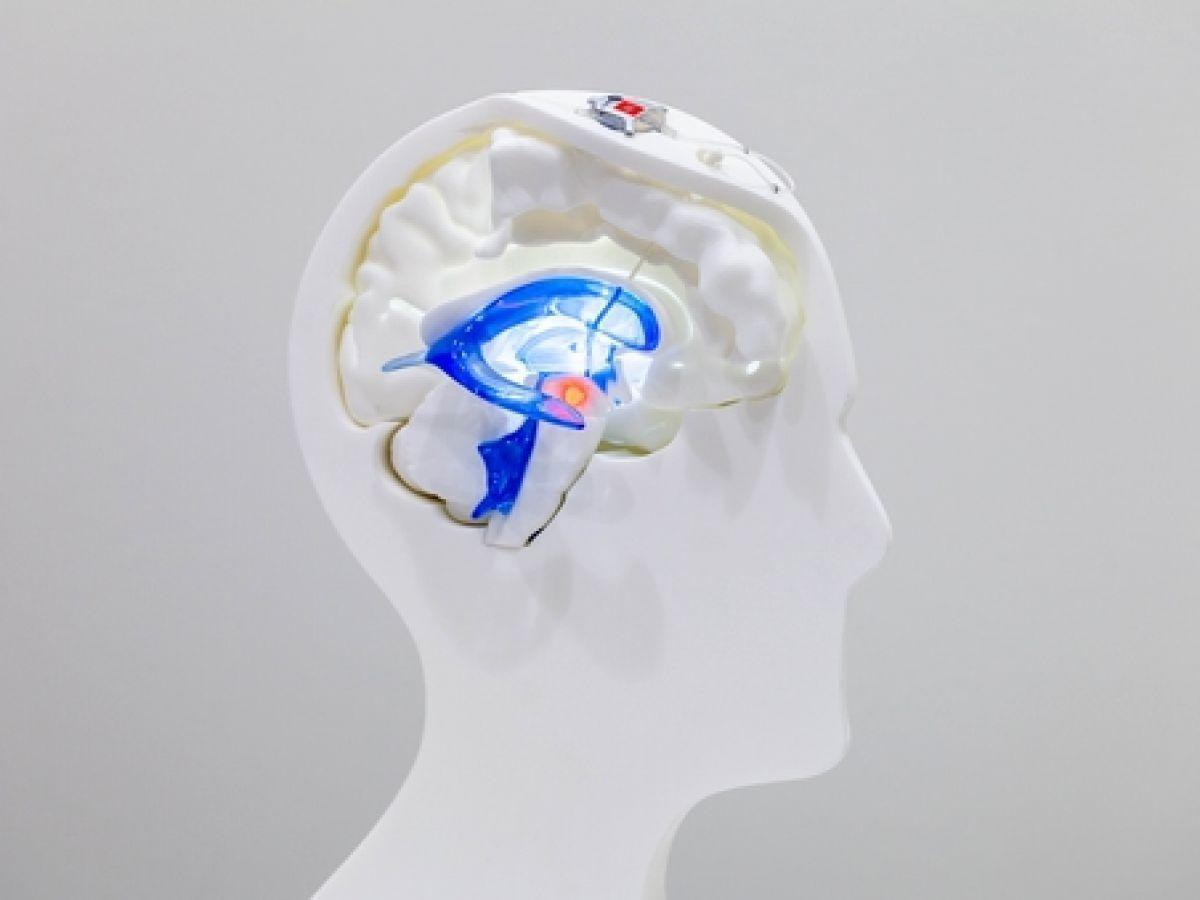
Derrière son appellation complexe se cache une technique thérapeutique innovante capitalisant sur les effets bénéfiques de la lumière pour améliorer la fonction cérébrale. Le dispositif NIR final, qui a fait l’objet de plus d’une dizaine de brevets, est constitué d’un stimulateur, qui fournit l’énergie implantée sous la clavicule du patient, d’un boîtier optique placé dans la boîte crânienne et d’une fibre optique passée dans les ventricules du cerveau délivrant la lumière infrarouge au niveau de la substance noire.
Maladie de Parkinson ou “maladie de l’énergie”
Lorsque l’on est atteint de la maladie de Parkinson, les neurones dopaminergiques, cellules très énergivores, meurent progressivement. Ceux-là mêmes qui sont responsables de la sécrétion de la dopamine dans la substance noire.
Les neurones qui constituent cette région – dont près de 400.000 neurones dopaminergiques – forment un réseau avec d’autres zones cérébrales. On peut notamment citer le striatum, région particulièrement impliquée dans le contrôle des mouvements, mais aussi dans les fonctions cognitives et comportementales. Ce n’est pas sans rappeler les symptômes de la “maladie de l’énergie” ainsi nommée par le professeur Stephan Chabardès, neurochirurgien au CHU Grenoble Alpes et directeur médical de Clinatec.
Les mitochondries sont les centrales énergétiques de la cellule. Dans la maladie de Parkinson, des altérations dans la fonction mitochondriale réduisent la production d’une molécule, l’ATP (adénosine triphosphate), affectant la survie et le fonctionnement des neurones. La cellule est privée de son carburant.
L’utilisation de lumière infrarouge n’est pas un hasard et repose sur un principe ancestral: la théorie endosymbiotique. Cette dernière explique l’origine des mitochondries comme d’anciennes bactéries devenues des composites indispensables aux cellules eucaryotes pour la production d’énergie.
Au fil du temps, le matériel génétique de la mitochondrie s’est mêlé à l’ADN nucléaire de l’hôte, perdant ainsi son indépendance.
Pour autant, la bactérie n’a pas dit son dernier mot puisqu’elle a conservé des photorécepteurs (molécules sensibles à la lumière) qui peuvent absorber l’infrarouge et en conséquence, renforcer sa production d’ATP et favorisant la réparation cellulaire et la survie neuronale.
“On voit une amélioration des effets moteurs sans médicaments. Les patients sont moins gênés en termes de rigidité, de raideur, de tremblements, ils n’ont pas besoin de prendre beaucoup de médicaments”, explique Stephan Chabardès. Il ajoute, optimiste: ” lorsqu’on prend une image de leur cerveau pour voir la dopamine, on s’aperçoit qu’elle se maintient, voire qu’elle augmente discrètement la première année. ”
“Je venais de déclencher la maladie, c’était un espoir formidable pour moi”
Au stade actuel, l’étude clinique débutée en 2021 dite de “preuve de concept” a pour vocation de démontrer la sécurité et la faisabilité du procédé.
L’étude implique sept patients parkinsoniens diagnostiqués depuis moins de deux ans (De Novo) auxquels le dispositif est implanté chirurgicalement. Un autre groupe De Novo traité uniquement par médicaments est étudié, et cela pendant 4 ans.
Aujourd’hui, 6 patients sur 7 ont été opérés sans le moindre effet secondaire notable.
L’un des patients témoigne: “Je venais de déclencher la maladie, c’était un espoir formidable pour moi”. Les patients semblent optimistes sur l’évolution de la pathologie et Stephan Chabardès également: “On est confiants et on a beaucoup d’espoir concernant notre technologie et l’évolution des patients”.
Alzheimer, troubles du sommeil et traumatismes crâniens: les perspectives
D’autres projets se profilent à l’horizon. La photobiomodulation intracrânienne commence tout juste à faire ses preuves quand de nouveau projets émergent dans l’esprit des chercheurs.
“La boîte crânienne peut être transparente à certaines longueurs d’ondes, ce qui pourrait nous permettre de traiter la maladie avec un casque bioluminescent”, précise Jean-Philippe Bourgoin, président du conseil d’administration du Fonds Clinatec et directeur adjoint de la recherche technologique du CEA.
La photobiomodulation transcrânienne offre des angles de recherche sur une variété de troubles: maladie d’Alzheimer, troubles du sommeil et même traumatismes crâniens sur lesquels pas moins de trois essais cliniques sont envisagés pour 2025.
Pour plus d’informations et d’analyses sur la Mali, suivez Africa-Press