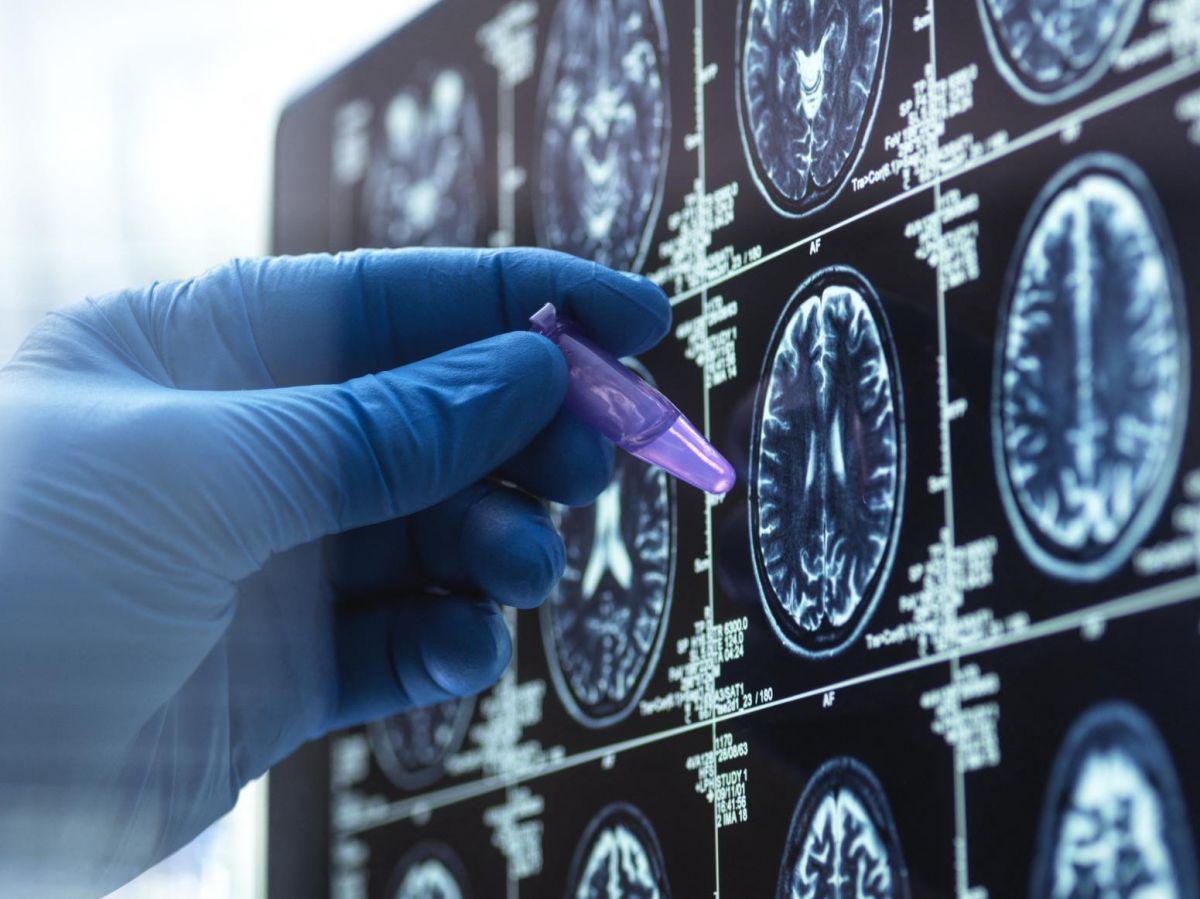
Africa-Press – Congo Brazzaville. A seulement quelques jours de la Journée mondiale contre la maladie d’Alzheimer, le 21 septembre, la Haute Autorité de santé (HAS) vient de refuser la demande d’accès précoce au Leqembi, premier traitement capable d’éliminer dans le cerveau les dépôts de protéines amyloïdes, élément majeur de la maladie neurodégénérative. Un coup dur pour les malades, leurs proches et la recherche, regrette auprès de Sciences et Avenir le Dr Marion Lévy, directrice scientifique de la Fondation Vaincre Alzheimer. Entretien.
« Nous ne nous attendions pas du tout à ce refus de la HAS »
Sciences et Avenir: Quelle est votre réaction à chaud à cette décision de la Haute Autorité de santé?
Marion Lévy: A la Fondation Vaincre Alzheimer, nous sommes extrêmement déçus par cette décision. Et nous sommes même assez surpris, nous espérions vraiment un avis positif. Nous ne nous attendions pas du tout à ce refus de la HAS, notamment car nous avions contribué à la demande d’accès précoce en lui fournissant un sondage réalisé auprès des malades et/ou de leurs proches. Celui-ci montrait de façon très nette que le traitement était très attendu, et ce malgré les effets indésirables qui étaient dument présentés (47% se déclaraient prêts à prendre le Leqembi si on le leur proposait, 8% s’y opposaient. En incluant ceux qui répondaient « peut-être », l’intérêt atteignait 73%, ndlr).
Nous avions aussi eu l’opportunité d’interroger des patients inclus dans l’essai clinique mené en France. Parmi eux, 54% rapportaient des effets positifs, en particulier une stabilisation de leurs symptômes. De fait, si on se place du point de vue du patient, la position de la HAS va être difficile à comprendre. D’autant que le problème avec cet avis négatif, c’est qu’on craint désormais que le traitement ne soit pas disponible sur le sol français avant l’année prochaine. Or d’ici là, les patients à un stade précoce ou modéré aujourd’hui éligibles pourraient ne plus l’être du fait de la progression de la maladie.
EN KIOSQUE. Retrouvez en septembre 2025 le dossier spécial de 18 pages que nous consacrons aux premiers traitements et premiers tests sanguins contre la maladie d’Alzheimer.
« Un patient qui aurait pu être éligible aujourd’hui ne le sera peut-être pas l’année prochaine »
Cela signifie au moins que vous espérez que la HAS pourrait finalement rendre un avis positif lors d’une procédure classique…
Oui tout à fait. La demande d’accès précoce qui vient d’être refusée est une procédure vraiment différente de la voie classique. Elle concerne les maladies pour lesquelles il n’existe aucun traitement et qui présente un caractère d’urgence à recevoir le traitement demandé. C’est le cas en l’occurrence puisque le Leqembi n’est indiqué que dans les stades précoce et modéré d’Alzheimer qui, rappelons-le, est une maladie neurodégénérative pouvant rapidement évoluer. Mais la décision de la HAS montre que visiblement, pour eux, ce n’est pas urgent.
Désormais, il faut miser sur la procédure classique. Ce premier refus, a priori, n’aura pas d’impact sur la seconde évaluation. De nouvelles données vont être analysées de façon plus poussée. Mais ce sera plus long et, encore une fois, un patient qui aurait pu être éligible aujourd’hui ne le sera peut-être pas l’année prochaine.
Par ailleurs, cette décision envoie un signal assez pessimiste, pas seulement pour les patients, mais pour la recherche et l’innovation thérapeutique. Clairement, on a l’impression que la France ne fait pas confiance à ces innovations et pourrait ainsi perdre de son attractivité au niveau de la recherche, qu’elle soit fondamentale ou clinique.
La HAS fait tout de même valoir des arguments. Notamment quant à la surveillance des effets indésirables du traitement qui nécessite de réaliser plusieurs IRM aux patients. Or, on sait que l’accès aux examens IRM en France est limité. N’est-ce pas une réserve audible?
L’Agence européenne du médicament a en effet conditionné l’autorisation du Leqembi à une surveillance des ARIAs, ces microhémorragies et œdèmes cérébraux qui peuvent survenir lorsque le traitement, en nettoyant les dépôts amyloïdes, endommage des vaisseaux sanguins dans le cerveau. Mais il ne s’agit pas de faire des IRM pendant tout le temps du traitement. Ce qui est recommandé, ce sont trois IRM sur les trois premiers mois, puis un quatrième examen après le sixième mois.
Or depuis l’autorisation au niveau européen, cela fait des mois que médecins et neurologues de la Fédération des centres mémoire en France se réunissent et réfléchissent au meilleur moyen d’organiser ce suivi indispensable. Ils avaient publié des recommandations dès février dernier où ils exploraient toutes les procédures permettant de rendre ce traitement accessible dans de bonnes conditions. L’idée était de commencer par des structures ayant toutes les compétences matérielles, techniques et médicales pour assurer ce suivi. C’était vraiment très bien réfléchi. Là, la HAS semble ne pas faire confiance à nos médecins.
Pour plus d’informations et d’analyses sur la Congo Brazzaville, suivez Africa-Press